放射性元素衰变的终点:铅的“魔幻”力量
作者:admin 来源:万象经验 作者Eugene Wang 发布时间:2024-04-02 访问量:1707
古时候,炼金术士们曾努力尝试将铅转化为黄金。然而,大自然的运作却恰恰相反。如果查看元素周期表,会发现大多数元素都具有放射性,它们的原子核不稳定。如果给予足够的时间,这些原子大多会衰变成铅。然后,它们就会一直保持这种状态。因为铅不仅稳定,它还是一种“魔幻”元素。这里的“魔幻”并非指炼金术士,而是现代科学家用来形容铅和许多其他元素的特性。在我们探索这种“魔幻”之前,让我们先回顾一些核物理学的基础知识。

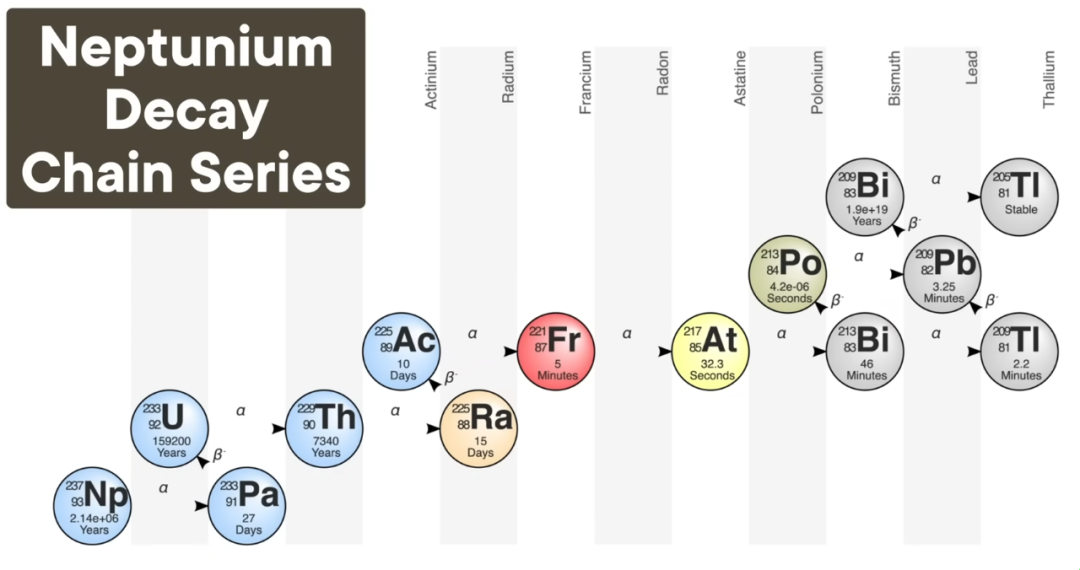
除了以上三条衰变链,还有一条不以铅结尾的衰变链:镎系。这条链中的同位素半衰期很短,大部分已经衰变完毕。科学家称这条链在自然界中已经“灭绝”,除了最后一步。链中倒数第二个同位素是铋-209,其半衰期接近20万亿年,是宇宙年龄的14亿倍。但如果我们快进到遥远的未来,这条链的最后一步是铊-205。这引出了一个重要问题:为什么有些同位素具有放射性,而另一些则稳定?
如果我们放大观察原子核,会发现质子都带正电,因此它们相互排斥。中子的加入可以中和这种排斥力。但随着质子数量的增加,保持稳定所需的中子也越来越多,这导致了一种称为稳定谷的模式。如果我们绘制所有已知同位素的中子和质子数量,会发现稳定的同位素都位于同一条线上。但中子与质子的比例只能维持到一定程度,一旦超过铅-208,所有同位素都变得不稳定,都具有放射性。即使在稳定谷内,也存在一些奇特的模式。例如,原子序数为49的铟只有2种稳定同位素,而它的元素周期表邻居锡却有多达10种稳定同位素。
早在 20 世纪40 年代,一位名叫玛丽亚·戈佩特·梅耶(Maria Goeppert Mayer)的化学家就注意到了这一特殊现象。当时她正在进行一个绘制各种同位素丰度图的项目,她注意到具有特定数量的质子或中子的同位素更有可能是稳定的。这些特殊的数字分别是2、8、20、28、50、82和126。
她认为这是核壳模型的证据,该模型中质子和中子在原子核内占据特定的能级,就像壳一样,每个壳都可以容纳特定数量的核子。当最外层壳完全充满时,原子核更紧密地固定其核子,使同位素更有可能保持稳定。这与电子的情况非常相似,化学教科书经常将电子描述为绕原子核的“壳”运行。当最外层壳充满时,元素的反应性就会降低,这就像元素周期表最右边的惰性气体,它们因具有完整的外电子层而显得惰性。
尽管当时电子壳层模型已被接受,但许多物理学家不接受戈佩特·梅耶的核壳层模型。他们更倾向于使用液滴模型,该模型将原子核视为质子和中子的集合体。物理学家尤金·维格纳(Eugene Wigner)尤其持怀疑态度,但他无法否认戈佩尔特·梅耶尔发现的模式。因此,他将这些稳定性数字称为“魔幻数字”(幻数),因为液滴模型无法解释它们。然而,这些数字并非只是魔幻,而且是核物理学的一个启示。
戈佩特·梅耶于1948年发表了她的发现,与此同时,德国物理学家汉斯·詹森(Hans Jensen)也独立得出了相同的结论。但这并没有导致学术竞争,反而促成了他们的合作,他们于1963年共同获得诺贝尔物理学奖。如今,公认的幻数仍然是戈佩尔特·梅耶尔首次发现的数字:2、8、20、28、50、82,对于中子来说是126。一些科学家认为114可能是质子的第七个幻数,但这尚未得到实验证明。
这些数字解释了为什么锡的同位素比铟更稳定,因为锡有50个质子,这是幻数之一。有些同位素具有双重幻数,因为它们的质子和中子数都符合幻数。最简单的例子是氦-4,它有两个质子和两个中子,这种同位素的极端稳定性是放射性元素(如钍-232)发生α衰变的部分原因,因为α粒子与氦-4核相同。这么多放射性元素衰变为铅,是因为铅具有幻数,而铅-208的同位素具有双重幻数。但这并不是故事的结局,因为物理学家仍在寻找新的幻数。
哪些数字是幻数,这是一个具有争议的话题。虽然幻数可以通过理论计算来预测,但科学家必须进行实验来实际测试给定同位素的稳定性。例如,2013 年,一项研究表明32和34 都是幻数。但2021年的一项后续研究通过测量特定钾核的大小来考察32。如果钾原子核一开始有32个中子,而32 又是一个幻数的话,那么如果再添加一个中子,你会发现它的大小会大幅增加。因为幻数指的是填充的外壳,因此第 33 个中子必须进入新的外壳,从而使整个原子核更大。但当研究团队实际测试时,他们没有观察到这种变化。因此他们得出结论,数字32 并没有什么神奇之处。
幻数还可以帮助科学家扩展元素周期表,并预测尚未发现的元素的稳定性。所有比铅-208重的元素都具有放射性,但在元素周期表的未知区域,可能存在一个假设的“稳定岛”,这里的同位素通过未经证实的幻数而具有相对较长的半衰期。该岛的中心可能是Flerovium-298,据说它具有双重幻数,拥有114个质子和184个中子。
上一篇:硅材料中的氧杂质
下一篇:碳化硅陶瓷件生产工艺和应用

 上海市智能制造产业协会
上海市智能制造产业协会 上海市集成电路行业协会
上海市集成电路行业协会 华东理工大学
华东理工大学